کودکان استثنایی
در این وبلاگ مطالبی راجع به کودکان استثنایی درج می شود.
کودکان استثنایی
در این وبلاگ مطالبی راجع به کودکان استثنایی درج می شود.روش های درمان اتیسم

1- رفتار درمانی
رفتار های کودکان اتیستیک اغلب برای والدین ودرمانگران مشکل آفرین وناراحت کننده است . این رفتارها ممکن است نامناسب ، تکراری ، تهاجمی وخطرناک باشد وهمینطور ممکن است شامل تکان دادن مکرر دست ها ، حرکت مداوم انگشتان ، تکان دادن بدن به جلو وعقب ، گذاشتن اشیاء در دهان و غیره باشد ، یا حتی خود آزاری باشد.
روش های فراوانی برای بهبود مشکلات اجتماعی ، کلامی ، حواس و رفتارهای اختلالی تهیه شده است . بعضی از این روش ها عبارتند از : اِی بی اِی ( ABA ) ، آموزش جزء به جزء ، فلورتایم ، داستان های اجتماعی و بهبود مجموعه حواس پنجگانه .
روش ABA : ( Applied Behavior Analysis )
اصل مهم این روش این است که رفتارهایی که مورد تشویق قرار بگیرند احتمال تکرار و افزایش خواهد داشت ورفتاهایی که مورد توجه قرار نگیرند احتمال حذف شدن آن ها وجود دارد . یکی ازروش های مهمی که بر پایه این اصل وجود دارد روش آموزش جزء به جزء می باشد .
روش آموزش جزء به جزء :
تمرینی که به کودک داده می شود شامل یک دستور به کودک ، یک عمل از طرف کودک و یک عکس العمل از طرف درمانگر می باشد . این روش علاوه بر تصحیح رفتارهای کودک شامل آموزش مهارت های جدید نیز از قبیل مهارت های اولیه مانند خوابیدن و لباس پوشیدن تا مهارت های پیشرفته مانند برخوردهای صحیح اجتماعی می باشد .
روش فلورتایم : Floor Time
این روش شبیه بازی درمانی است . در این روش سعی بر این است که ارتباط کودک با یک فرد دیگر از طریق برنامه های دقیق بازی بیشتر و مؤثر شود . در این روش که شش مرحله است کودک در طی آن تقلید و چگونه یاد گرفتن را از یک بزرگتر فرا می گیرد و به عبارتی کودک باید نرده بام شش پله ای را طی کند . در این روش در کنار روش های دقیق دیگر مثل ABA در ساعت فراغت کودک استفاده می شود .
داستان های اجتماعی
این داستان ها برای آموزش مهارت های اجتماعی کودکان اتیستیک آماده شده اند . از طریق این داستان ها به کودک آموزش داده می شود که چگونه احساسات ، منظور، و برنامه های دیگران را درک کنند . این داستان ها در صورت همراهی با تصویر و موسیقی می توانند تأثیر بیشتری داشته باشند . بایستی داستان های فراهم شده به گونه ای باشند که نقاط ضعف کودک را تصحیح کنند . مثلاً کودکی که از شرایط بخصوص ترس دارد یا در او ایجاد استرس می کند بهتر است داستان های مناسبی در مورد این شرایط برای او گفته شود .
درک مجموعه حواس
اغلب کودکان اتیستیک از نظر حس های بدن دچار مشکل هستند ممکن است دارای آستانه تحریک بالا یا پایین باشند یا مغز آن ها قادر نیست از اطلاعات بدست آمده از حواس پنجگانه درک درستی از شرایط موجود بدست آورد . در این روش درمانی که می تواند توسط بازی درمان ، کاردرمان یا گفتاردرمان انجام می شود به کودک کمک می شود تا بهتر از اطلاعات حسی بهره برد .
2- درمان های داروئی و رژیمی
از آنجایی که اتیسم یک طیف از بیماری های مشابه است نمی توان گفت یک درمان خاص برای همه این طیف مؤثر باشد . ولی به هر حال متخصصین و خانواده ها با این نتیجه رسیده اند که با استفاده از چند روش درمانی یا ترکیبی از آن ها می توان به کودکان اتیستیک کمک کرد تا رفتارهای اختلالی آ نها بهتر شده و عملکرد کلی آن ها پیشرفت کند . این ترکیب درمانی می تواند از روش های روانشناسی و دارویی باشد . تا کنون دارویی کشف نشده که از بروز اتیسم جلوگیری کند یا آن را درمان کند ، ولی بعضی داروها در بهبود بعضی از اختلالات اتیسم مؤثر است نظیر :الف : هالوپریدول با دوزهای کم برای ایجاد تسکین و خواب آوری در مطالعات کنترل شده موجب کاهش کناره گیری ، حرکات کلیشه ای و بیش فعالی گردید.
ب : لیتیوم و داروهای ضد صرع ممکن است مفید واقع شوند . داروهای ضد صرع برای کنترل تشنج استفاده می شود .
ج : فن فلورامین که به کاهش سطح سروتونین در مغز منجر می شود و همچنین در کاهش بیش فعالی و افزایش دامنه توجه تأثیر دارد .
د : ریسپریدون در گزارش های روایتی مفید بوده است .
همچنین مشاهده شده است که تغییرات رژیم غذایی و افزون برخی ویتامین ها و مواد معدنی می تواند در بهبود برخی اختلالات اتیسم مؤثر باشد .
افزودن برخی ویتامین ها مانند B6 و B12 و حذف برخی مواد مانند گلوتین و کازئین از رژیم غذایی کودک می توان در بهبود عملکرد سیستم گوارشی ، آلرژی ها و رفتارهای کودک تأثیر مثبت داشته باشد . البته تمام تحقیقات این امر را به صورت عملی ثابت نمی کند .
شاید بتوان گفت یکی از بیشترین ویتامین های مورد استفاده ویتامین B باشد که در ساختن آنزیم هایی که مغز برای فعالیت خود به آن ها احتیاج دارد مؤثر است . در 18 تحقیقی که در این مورد انجام شد تأثیرات مثبتی در بهبود رفتار ، بهبود تماس چشمی ، توجه بیشتر ، افزایش توانایی یادگیری مشاهده شد .
در بعضی کودکان روغن جگر ماهی که حاوی ویتامین A و D می باشد تأثیراتی در بهبود تماس چشمی و بهبود رفتار مشاهده شد . ویتامین C نیز در عملکرد بهتر مغز تأثیر دارد و استفاده از آن برای کودکان اثرات مثبت داشته است . البته استفاده از ویتامین ها باید تحت نظر متخصص کودکان باشد تا استفاده بیش از حد باعث مسائل دیگری نشود .
در برخی کودکان اتیسم پروتئین هایی نظیر گلوتن و کازئین خوب شکسته نمی شود و باعث ایجا مشکلاتی در کودک می شوند ، حذف آن در رفع اختلالات گوارشی مؤثر است و رفتارهای اختلالی ناشی از آن هم حذف می شود . گلوتن در غلات و کازئین در لبنیات وجود دارد البته قطع ناگهانی هم باعث ایجاد مشکل است و باید تحت نظر پزشک صورت گیرد و حتماً با یک متخصص تغذیه مشورت شود تا نحوه حذف این مواد و تغییر مناسب رژیم غذایی را به والدین آموزش دهد .
3- روش های درمانی مکمل
با وجود اینکه تشخیص زود هنگام و درمان زود هنگام اتیسم بهترین روش در کمک به این کودکان و درمان آن ها است . برخی از والدین و محققین معتقدند که روش های درمانی مکمل دیگری نیز وجود دارند . که می توانند ارتباط کودک با دنیای اطراف و سایرین را بهبود بخشیده و رفتارهای آن ها را بهتر کند . از انواع این درمان ها می توان به موسیقی درمانی ، هنر ، حیوان درمانی اشاره کرد که می توانند به صورت فردی با کودک کار شده و یا در مراکز مخصوص به صورت جمعی کار شوند .در تمامی این روش ها افزایش قدرت ارتباط ، بهبود روابط اجتماعی و افزایش اعتماد به نفس مشترک می باشند .
همچنین این روش ها کمک می کنند تا کودک بتواند رابطه ای بی خطر و مفیدی را با درمانگر خود و سایرین برقرار کرده و با آن ها مأنوس شود . موسیقی و هنر بخصوص می توانند در رفع مشکلات حواس پنجگانه کودک مفید باشند زیرا توسط آن ها قدرت درک ، شنوایی ، دیداری کودک تقویت می شوند . حیوان درمانی معمولاً شامل اسب سواری و بازی با دولفین ها می باشد . در این درمان ها کودک توانایی هماهنگی عضلات و اندام ها را می تواند بدست آورد همچنین احساس دوست داشتن و اعتماد به نفس نیز از فوائد این نوع درمان است .
4- آغوش درمانی
یکی دیگر از روش هایی که در مورد کودکان اتیسم به کار می رود آغوش درمانی است . در این روش پدر یا مادر خود را علیرغم گریه کردن ، جیغ کشیدن ، لگد زدن و مبارزه او آن قدر به زور نگه می دارد تا کودک آرام شود .
این کار ممکن است یک ساعت طول بکشد و پدر یا مادر را از نفس بیندازد ولی در عوض در پایان این مدت مرحله ای از تماس جسمانی همراه با محبت ، آرامش و ملایمت بین کودک و پدر یا مادر آغاز می شود و کودک می آموزد نسبت به شما پاسخ دهد و ارتباط برقرار کند و آشکارا به تبادل عشق و محبت می پردازد .
منبع: ایران اتیسم
اوتیسم چیست؟

اتیسم نوعی اختلال مغزی مقارن با تولد است که بر نحوه ی استفاده ی مغز بر اطلاعات تاثیر می گذارد.علت اصلی اتیسم هنوز شناخته نشده است.برخی پژوهش ها چنین نشان می دهند که اتیسم نوعی مشکل فیزیکی است که بر قسمت هایی از مغز که به فرایند زبان و اطلاعات ناشی از حواس پنج گانه می پردازد تاثیر می گذارد.ممکن است علت آن عدم تعادل برخی عناصر شیمیایی در مغز باشد.در برخی موارد نیز عوامل ژنتیکی تاثیر گذار بوده اند.خلاصه اینکه اتیسم در حقیقت نتیجه ی ترکیب چندین عامل مختلف است
چندین دهه قبل این نظریه داده شد که اوتیسم در کودکانی ایجاد می شود که توسط والدین سرد پس زده شده اند ( والدین یخچالی) و آنها را مقصر انحراف از نرمال کودکان کم سن می دانستند. اما مطالعات خانوادگی این مطلب را اثبات نکردند. خیلی مهم است که بطور مکرر با والدین کودکان اوتیستیک ارتباط ایجاد شود.
علت اختلالات اوتیستیک ناشناخته است . نظریات شامل عوارض بارداری ، عفونتها ، ژنتیک و در معرض قرار گیری با توکسین ها می باشد.
عوارض بارداری
- عوارض بارداری با افزایش خطر بروز اوتیسم همراه است اما مشخص نیست که آیا عوارض بارداری سبب اوتیسم می شود یا هر دو ناشی از یک علت دیگر می باشند.
عفونتها
- یک زمینه عفونی در بعضی افراد اوتیستیک این پیشنهاد را داده است که ممکن است عفونت عامل اوتیسم باشد کما اینکه در اپیدمی های سرخجه احتمال بروز اوتیسم بالاتر می رود. این یافته ها این نظریه را ارائه می کنندکه عفونت با سرخجه آسیب پذیری برای ایجاد اوتیسم را در جنین ایجاد می کند.
ژنتیک
- یک توزیع ژنتیکی نیز برای اوتیسم شناخته شده است.
- - مطالعات متعدد خانوادگی پیشنهاد داده است که یک جزء ژنتیکی در خانواده های این افراد وجود دارد. برای مثال بسیاری مطالعات نشان داده اند که بعضی وابستگان بدون علامت درجه اول این افراد ابنرمالیتی هایی در میزان سروتونین و دیگر مواد شیمیایی مشابه پیش ماده های آن دارند. اما به هر حال یک فرد اوتیستیک مشخص ممکن است صفت فامیلی خاصی را که در جمعیت افراد اوتیستیک دیده شده نشان ندهد. - - یافته های ژنتیکی اوتیسم یکی از اهداف آینده تحقیقات است. اما به هر حال فایده مطالعات بالینی خانواده افراد اوتیستیک مشخص نشده است.
توکسین ها
- در معرض توکسین قرار گرفتن به عنوان یکی از علل اوتیسم پیشنهاد شده است . گرچه در معرض قرار گرفتن در بعضی افراد اوتیسم مشخص شده اما یک نقش علتی در کلیه افراد اوتیستیک ثابت نشده است. مناطق خاصی از زمین ممکن است به علت وجود توکسین های خاص بروز مشخصی داشته باشند مثلا" افزایش اوتیسم در مناطق خاصی از ژاپن را به علت توکسین منتقل شده از ماهی می دانند. گرچه توکسین ها ممکن است نقشی در بعضی افراد اوتیستیک در ژاپن داشته باشد اما در کل ژاپن این مطلب بطور عموم به عنوان علت ثابت نشده است. یکی دیگر از دلایل میزان بالای اوتیسم در ژاپن را آموزش و دقت زیاد پزشکان ژاپنی می دانند.
- بروز اوتیسم بعد از واکسیناسیون سرخک ، اوریون و سرخجه به این نظریه هدایت شده که اوتیسم ممکن است به علت واکسیناسیون ایجاد شود اما مطالعات دقیق ارنباط بین واکسیناسیون سرخک ، اوریون و سرخجه را با اوتیسم ایجاد شده متعاقب آنها را در جمعیت عمومی نشان نداده است.
مطالعات آزمایشگاهی:
- در یک سوم افراد میزان سروتونین افراد اوتیستیک افزایش یافته است سطح افزایش یافته سروتونین در والدین و برادر خواهر های فرد مبتلا نیز دیده می شود.
- بیوتینیداز سرم در بعضی افراد اوتیستیک کاهش یافته
- مطالعات ایمونولوژیک برای تشخیص ابنرمالیتی ها نظیر کاهش غلظت پلاسمایی پروتئین کمپلمان C4B بسیار مفید است
- افزایش واکنش پذیری پروتئین بتا اندورفین با انتهای C در افراد اوتیستیک و مادرانشان
مطالعات تصویر برداری
MRI
- مطالعات ناسازگار هستند اما یافته هایی بدست آمده است ، شامل بزرگی کلی مغز ، بافت کلی مغز و بطنهای طرفی و چهارم مغز همزمان با کاهش سایز مغز میانی ، مدولا اوبلونگاتا ، نیمکره های مخچه و لوبهای کرمی شکل ( Vermal) VI و VII
- هنگامی که هیپوپلازی در بعضی افراد اوتیستیک دیده شد در تعدادی دیگر افراد هیپر پلازی دیده شد !
- افراد اوتیستیک که سرشان را می کوبند ممکن است بزرگی دوگانه فضا در استخوانهای پاریتال و اکسیپیتال با کاهش ماده خاکستری نزدیک به تغییرات استخوانی داشته باشند. این یافته ها شبیه بوکسورهایی است که دچار آنسفالوپاتی و دمانس پوگیلیستیکا می شوند dementia pugilistica
CT Scan
مطالعات با یکدیگر سازگار نیستند اما می توانند نواقصی را نشان دهند که شامل بزرگی بطنها ، هیدروسفالی ، ضایعات پارانشیمال و کاهش اندازه هسته دمی caudate nucleus
PET
در توموگرافی انتشاری پوزیترون PET نواقص متعددی مشاهده شد اما هیچکدام در همه افراد مبتلا به اوتیسم دیده نمی شود و نتایج در افراد متفاوت هستند.
- در تصویر برداری با 18 فلورین 2 داکسی گلوکز شیار مستقیم جلویی در سمت چپ بزرگتر از سمت راست است که برعکس آسیمتری موجود در افراد نرمال است .
- در بعضی افراد میزان متابولیسم گلوکز در کورتکس کالکارین پشتی سمت راست افزایش یافته است در حالیکه میزان متابولیسم گلوکز در پوتامن پشتی چپ و تالاموس داخلی چپ کاهش یافته است.
SPECT
با این روش جریان خون ناحیه ای مغز با گزنون 133 اندازه گیری می شود که کاهش متابولیسم نیمکره چپ مغز در بعضی افراد دیده شده است.
EEG
- با آنسفالوگرافی اختلال تشنج ، آفازی اکتسابی با تشنج ( سندرم لاندا کلفنر ) ، آنسفالوپاتی نوزادی پاسخ دهنده به بیوتین و حالات مرتبط بررسی می شود. مشاوره با یک متخصص الکترو انسفالوگرافی کمک می کند به روش درمانی مناسب و متناسب با نوار مغز دست یابیم
- یک آنسفالوگرافی نرمال ابنرمالیتی های تشنجی را رد نمی کند
- وقتی یک الکترو آنسفالوگرام معمولی شواهد مشخصی از تشنج در یک بیمار مشکوک به تشنج مثل تشنج پارشیال با علائم کمپلکس را مشخص نمی کند اتخاذ روشهای تخصصی ممکن است به روشن شدن تشخیص کمک کند. اندازه گیری های الکتروآنسفالوگرافیک بعد از محرومیت از خواب و بعد از تحریک با نور و صدا و حس لامسه با استفاده از لیدهای نازوفارینژیال و همزمان با مونیتور ویدیویی ممکن است کمک کننده باشند.
- بستری در یک بیمارستان برای ارزیابی با مونیتور ویدیویی 24 ساعته همزمان با الکتروآنسفالوگرافی و حرکت کودک برای چند روز ممکن است در تشخیص یا رد اختلالات تشنجی کمک کننده باشد.
تصویر برداری با رادیو ایزوتوپ
بررسی جریان خون موضعی مغز با تکنسیوم m99 که به اکسید هگزا متیل پروپیلن آمین (HMPAO) که یک ماده لیپوفیل است آنومای های متنوعی را نشان می دهد از جمله کاهش در ورمیس ، نیمکره های مخچه ، تالاموس ، گانگلیون های پایه ای و لوبهای پاریتال و تمپورال . این یافته ها پیشنهاد می کند که یک ابنرمالیتی خاص در تمام افراد اوتیستیک دیده نمی شود و ممکن است کلاسهای بیولوژیکی خاصی با انواع مشخص اختلال جریان خون مغز وجود داشته باشد.
دیگر آزمایشات
- مسمومیت با سرب توسط آزمایشات مناسب کنار گذاشته شود
ارزیابی های روانی-فیزیولوژیکی
- کودکان به احتمال زیاد در دوره تنفسی پاسخهای خوگیری از خود نشان نمی دهند ، فعالت الکتریکی پوست و وازوکانستریکشن در پاسخهای تقویت شده ضربانی محیطی بطور مکرر تحریک را در کودکان تیپیک نشان می دهد.
- کودکان اوتیستیک ممکن است بیش انتخابی شنوایی داشته باشند.
پاتوفیزیولوژی
تحقیقات پیرامون پاتوفیزیولوژی اختلالات اوتیستیک در نیم قرن گذشته ادامه داشته اما علت اصلی بیماری هنوز در پرده ابهام قرار دارد. سه زمینه اصلی مشخص شده شامل مونوآمین ها ( سروتونین (5 هیدروکسی تریپتامین5HT، دوپامین ، نوراپینفرین) و گلوتامات آمینو بوتیریک اسید و نوروپپتیدها می باشد .
نقش واسطه های شیمیایی در بروز اوتیسم
مونوآمین ها
1-سروتونین
نورون های سروتونینی بطور وسیعی در سراسر مغز پستانداران گسترده شده است و یکی از اولین نوروتراتسمیتر ها در مراحل نموی مغز است و میزان turn over این ماده در مغز پستانداران نابالغ immature بسیار بالاتر از دیگر پستانداران است. سروتونین هم نقش اساسی در رشد و نمو به عنوان فاکتور رشد در مغز نابالغ دارد و هم تکثیر و بلوغ اعصاب را به عهده دارد. اولین تحقیقات در پاتوفیزیولوژی اوتیسم روی 5HT انجام شده است. در تحقیقات اولیه با اندازه گیری سطح کلی سروتونین در خون این ظن پدیدار شد که سطح سروتونین در افراد اوتیستیک بالاتر از افراد نرمال است اما بعدها مشخص گردید که این اندازه گیری ها بیشتر از معمول تخمین زده شده بود و شاید به دلیل عدم کنترل نژادی و بلوغ جنسی بوده است اما بیشتر مطالعات بعدی این مطلب را مشخص ساخت که سطح بالای ابتدایی سروتونین در کودکان اوتیستیک در طی رشد آنها تمایل به بالا ماندن دارد در حالیکه در کودکان نرمال با افزایش سن تمایل به کاهش دارد. این نکته می تواند اشاره به بلوغ غیر طبیعی سیستم سروتونینی در کودکان اوتیستیک می کند. اما دفع ادراری 5 هیدروکسی ایندول استیک اسید) 5HIAA) که متابولیت اولیه 5 هیدروکسی تریپتامین 5HT)) می باشد و غلظت خونی تریپتوفان در کودکان اوتیستیک و نرمال تفاوت بارزی نداشتند.
مطالعات نشان داده اند که عملکرد 5HT و سطح 5HIAA در مایع CSF تفاوتی بین کودکان اوتیستیک و نرمال نمی کند در مطالعات رفتارهای نورواندوکرین ها که در افراد اوتیستیک انجام شده است پیش ماده بلافصل 5HT به نام 5 هیدروکسی تریپتوفان 5HTP)) مورد بررسی قرار گرفته است و دیده شده است پاسخ پرولاکتین به5HTP در کودکان اوتیستیک کمتر از افراد نرمال بوده که نشان دهنده پاسخ ضعیف مرکزی به 5HT می باشد.
آزاد سازی آهسته پرولاکتین در پاسخ به مصرف 60 میلی گرم فن فلورامین دهانی در یک بررسی بر روی 7 نفر پسر مبتلا به اوتیسم در مقایسه با افراد نرمال دیده شد . با یک استراتژی دیگر به 17 بیمار بالغ مبتلا به اوتیسم موادی که باعث کاهش سطح تریپتوفان می شد و موادی که باعث افزایش سطح تریپتوفان می شد تجویز کردند در 11 مورد از 17 بیمار که سطح خون تریپتوفان آنها بالاتر رفته بود علائم واضح اوتیسم شامل چرخیدن ، آویختگی ، قدم زدن ، بر خوردن به جایی ، خود زنی ، حرکات دورانی و جنبیدن ،و راه رفتن روی انگشتان پا بروز کرد . در یک مطالعه دیگر با آگونیست رسپتور تریپتامین به نام sumatriptan که باعث افزایش هورمون رشد می شود دیده شد که افراد مبتلا به اوتیسم و آسپرگر افزایش بیشتری در هورمون رشد نشان دادند که نشان دهنده یک نوع بیش حساسی hypersensitivity به تریپتامین است و در یک مطالعه مرتبط دیگر دیده شد که حرکات تکراری در این کودکان با بیش حساسی هورمون رشد به sumatriptan ( آگونیست رسپتور تریپتامین) همراه است . در یک مطالعه دیگر نیز مشخص شده است که دریافت خوراکی Mکلروفنیل پیپرازین سبب افزایش رفتارهای تکراری و پرولاکتین در بالغین با اوتیسم و آسپرگر می شود.
در مورد ژن های درگیر در اوتیسم، ناقل 5HT که محل عملکرد مهارکننده های جذب مجدد سروتونین است کاندید بررسی و مورد توجه قرار گرفته است cookو همکاران اولین کسانی بودند که نقص در قسمت پروموتور ژن ناقل تریپتامین را گزارش نمودند.
تریپتوفان 2و3 داکسیژناز آنزیم محدود کننده کاتابولیسم تریپتوفان است که به نظر می رسد نقص ژن این آنزیم نیز در افراد اوتیستیک وجود داشته باشد. (nabi و همکاران). بررسی های اخیر در جستجوی ارتباط بین موضوعات اوتیستیک و رفتارهای اجباری سخت است که نتایج تشویق کننده ای داشته باشد.
مطالعات تصویری عصبی سیستم 5HT در بیماران اوتیسم کامل شده است و در مطالعه با روشPET با مولکول آلفا متیل ال تریپتوفان (AMT) حاوی کربن 11 در کودکان اوتیستیک پسر دیده شد که سنتز 5HT در کورتکس فرونتال ، تالاموس و مخچه عدم تقارن بارز داشت ولی در برادر خواهر های آنها این عدم تقارن دیده نشد. محققان نتیجه گرفته اند که تجمع موضعی 5HT ممکن سبب عصب دهی غیر طبیعی و نامربوط یا اختلال کارکرد فیزیولوژیکی این اعصاب می شود .
در یک مطالعه دیگر بر روی متابولیسم 5HT مشخص گردید که توان سنتز5HT در کودکان تا سن 5 سالگی بیش از 200 درصد بالغین است اما بعد از این سن کاهش می یابد ولی در کودکان اوتیستیک توان سنتز این ماده از سن 2 سالگی به تدریج افزایش می یابد تا به حد 5/1 برابر بزرگسالان برسد .از این مطلب این نتیجه را می شود گرفت که مغز انسان در دوران کودکی توان بالایی در سنتز 5HT دارد که در کودکان اوتیستیک این توان بنا به دلایلی قطع شده است.
2-دوپامین
آزاد سازی دوپامین (DA) در مغز همراه با اثرات حرکتی و شناختی می باشد. نقش دوپامین بر اساس اثرات داروهای آنتاگونیست رسپتورهای D2 در درمان این گروه از بیماران مشخص شده است. این گروه از داروها با اثر بخشی روی علائم اوتیسم نظیر تهاجم ، رفتارهای خود آزاری و بیش فعالی در درمان این بیماران موثر می باشد.
در مقیاس وسیعی تحقیقات روی دوپامین بر روی اندازه گیری متابولیت دوپامین به نام همووانیلیک اسید HVA در ادرار و پلاسما و مایع مغزی نخاعی انجام گرفته است . لازم به ذکر است که تنها 25% از متابولیت دوپامین در مایع پلاسما دیده می شود و بنابر این فقط تغییرات عمده در غلظت دوپامین مایع مغزی نخاعی در مایع پلاسما منعکس می شود.
در مطالعاتی که بر روی متابولیسم کاتکولامین ها در 22 کودک اوتیستیک 5 تا 16 ساله با گروه کنترل شده سنی و جنسی انجام گرفت تغییرات مشخصی در میزان دوپامین ادرار دیده نشد.
در مطالعه ای دیگر توسط Mindreaa و همکارانش بر روی سطح پلاسمایی دوپامین و متابولیتش HVA و پرولاکتین در بیماران اوتیستیک و گروه کنترل انجام گرفت تغییرات بارزی یافت نشد.
در مطالعه ای دیگر توسط Martineau بر روی سطح ادراری دوپامین و متابولیتهای آن شامل HVA و 3 متوکسی تیرامین 3MT و نور اپینفرین و اپی نفرین در 156 کودک اوتیستیک در مقایسه با کودکان هم سن با عقب ماندگی ذهنی و کودکان نرمال انجام گرفت. در هر سه گروه متناسب با سن سطوح این متابولیتها کاهش می یافت و کاهش بارزی در سطوح دوپامین و متابولیت آن HVA در بیماران درمان شده در مقایسه با بیماران درمان نشده دیده شد . این محققین ابراز داشتند که احتمالا" نتایج ناشی از یک نقص در بلوغ سیستم مونوآمینرژیک در بیماران اوتیسم باشد .
چندین مطالعه روی سطح مایع مغزی نخاعی HVA انجام شده است در مطالعه ای که توسط Gillberg & Svennerholm انجام شده سطح متوسط HVA در مایع مغزی نخاعی تا 50 درصد در کودکان اوتیستیک در مقایسه با کودکان هم سن و جنس آنها
با اختلالات نورولوژیک افزایش یافته است.
اما در یک مطالعه کنترل شده روی HVA مایع مغزی نخاعی در 9 کودک اوتیستیک درمان شده با فن فلورامین سطح نرمال HVA در مایع مغزی نخاعی دیده شد . همچنین Nsarayan و همکارانش نیز سطح نرمال HVA را در مایع مغزی نخاعی یافتند.
در مطالعات متعدد انجام شده روی اندازه گیری HVA در مایع مغزی نخاعی در گروههای بیماران اوتیستیک تغییرات مشخصی اثبات نشده است
بعضی از مطالعات ژنتیکی روی رسپتورهای دوپامین صورت گرفته است. در مطالعه ای که توسط comings و همکارانش بر روی تعدادی از بیماران خصوصا" بیماران اوتیستیک صورت گرفته است دیده شده که آلل A1 رسپتور D2 رسپتور دوپامین بطور واضحی افزایش یافته است . در یک مطالعه دیگر ژنهای رسپتور D1 و D5 دوپامین از طریق محدودیت تکثیر داخل هسته ای مشکل دار تشخیص داده شدند.
دکتر رابینسون و همکارانش ژن دوپامین بتا هیدروکسیلاز DA B Hydroxilase (DBH) را به عنوان کاندید اتیولوژی بیماری در 37 خانواده با 2 یا بیشتر کودک PDD مورد بررسی قرار دادند. این آْنزیم دوپامین را به نوراپینفرین کاتالیز می کند. افزایش تشابهی بین آلل های مشابه در برادر خواهرها وجود نداشت اما این آللها با فرکانس بالاتری در مادر آنها با افتادگی در 19 جفت از ژن مربوطه دیده می شد.
فعالیت دوپامینرژیک از طریق تکنیکهای تصویر برداری عصبی با استفاده از PET و نشانگر فلورودوپا FDOPA انجام شده است .
ارنست و همکارانش این روش را بر روی 14 کودک 8 پسر و 6 دختر اوتیستیک در مقایسه با 10 کودک نرمال جهت کنترل انجام دادند در گروه کودکان اوتیستیک تجمع FDOPA در کورتکس فرونتال قدامی و میانی بطور واضحی تا 39% کاهش یافته است .
در یک مطالعه دیگر روش PET بر روی 6 کودک 3 تا 5 ساله با اوتیسم که با 6R-L-erythro-5,6,7,8-tetrahydrobiopterin (R-BH4) درمان شده بودند انجام گردید . این آنزیم یک کوفاکتور برای تیروزین هیدروکسیلاز در مسیر بیوسنتز کاتکولامین هاست. محققین در صورتی که سطح پایین نسبی R-BH4 در مایع مغزی نخاعی می یافتند انجام می دادند. پیش از درمان PET میزان افزایش یافته ای از DA D2 Receptor در هسته دمی caudate nucleus و پوتامن در کل دیده شد . بعد از درمان یک کاهش 10 درصدی در رسپتورهای D2 دوپامین دیده شد و علاوه بر این سطح مایع مغزی نخاعی R-BH4 بطور واضحی افزایش یافت .
3- نوراپینفرین( NE)
نور اپینفرین با برانگیختگی ، حافظه ، اضطراب ، و فعالیت اتونومیک همراه است. این نورو ترانسمیتر از دوپامین ساخته می شود و به وانیل مندلیک اسید VMA در محیط و به 3 متوکسی 4 هیدروکسی فنیل گلیکول MHPG در مایع مغزی نخاعی تبدیل می شود.
سطح خونی نوراپینفرین و متابولیتهای آن با سطح آن در مایع مغزی نخاعی همخوانی دارد . در مطالعاتی که بر روی کودکان اوتیستیک با اندازه گیری متابولیتهای نور اپینفرین MHPG و VMA انجام گردیده است تغییر واضحی بین کودکان اوتیستیک و نرمال دیده نشده است.
4- گلوتامات و گابا
گلوتامات ، نوروترانسمیتر آمینو اسیدی تحریکی است که با غلظت بالایی در سراسر مغز دیده می شود. تصور می شود که این نوروترانسمیتر بطور قاطعی در شکل پذیری و اعمال شناختی بالاتر نقش دارد. رسپتورهای گلوتامات به انواع متابوتروپیک و اینوتروپیک تقسیم می شوند. رسپتورهای اینوتروپیک به سه خانواده تقسیم می شوند. N-Methyl-D-aspartate(NMDA) و Alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid(AMPA) و Kinate
بسیاری از محققین تصور می کنند که بد عملکردی گلوتامات ممکن است علت اوتیسم باشد.
GABA نوروترانسمیتر آمینواسیدی دیگری در مغز است که نوروترانسمیتر مهاری اولیه در مغز محسوب می شود. این ماده از گلوتامات بوسیله گلوتامیک اسید دکربوکسیلاز(GAD) تولید می شود محققین تصور می کنند که گابا نقش اساسی در پاتوفیزیولوژی اوتیسم دارد. علیرغم نقش مهمی که این نوروترانسمیتر ها می توانند داشته باشند اما تعداد اندکی تحقیق در این زمینه انجام شده است .
تعدادی از گزارشات نشان دهنده سطح افزایش یافته گلوتامات در بیماران اوتیسم و دیگر انواع PDD می باشند.
در تحقیقی که توسط Aldred و همکارانش انجام شد در نمونه های 23 بیمار مبتلا به اوتیسم و آسپرگر با سن 4 تا 29 سال در مقایسه با 55 عضو خانواده آنها ( 32 والد و 23 خواهر برادر) غلظت اسید آمینه های خون از جمله گلوتامات ، فنیل آلانین، لیزین و آسپارژین بطور بارزی در بیماران و خانواده های آنها بالاتر از گروه کنترل همسن آنها بود. سطوح گلوتامین بطور بارزی پایین تر بود.
در مطالعه ای دیگر آمینو آسیدهای 14 کودک اوتیستیک زیر 10 سال اندازه گیری شد و با گروه هم سن و هم جنس خود مقایسه شدند. در این مطالعه آسپارتات بالاتر و گلوتامین و آسپارژین پایین تر از گروه کنترل بودند.
اما در آنالیزهای دیگر این مطلب ثابت نشد در مطالعه ای توسط Rolf و همکارانش بر روی 18 نمونه پلاسمای حاوی پلاکت کودکان اوتیستیک سنین 8 تا 14 ساله گلوتامات و آسپاراتات کاهش یافته بودند و سطوح گلوتامین و گابا نیز کاهش یافته بودند . اما در مطالعه ای دیگر توسط Dhossche خلاف این مطلب ثابت شد
نتیجه اینکه اندازه گیری های آمینو اسیدهای خون محیطی نتایج همگونی نداشته اند و قابل استناد نیستند و علل آن می تواند تعداد نمونه های اندازه گیری شده ناچیز و روشهای متفاوت اندازه گیری و احتمالا" دارو درمانی در بیماران قبل از آزمایش است.
مطالعات ژنتیکی روی سیستم گلوتامات و گابا در بیماران اوتیستیک انجام شده است .jamain و همکارانش نشان دادند که ژن رسپتور اینوتروپیک کینات2 گلوتامات (GRIK2) یا ژن رسپتور 6 گلوتامات (GluR6) در بیماران اوتیستیک دارای عدم تعادل است و یک انتقال زیادی مادری GRIK2 دیده می شود و جالب اینکه این عدم تعادل در انتقالGRIK2 در بیماران اسکیزوفرنی نیز دیده می شود . در مطالعه ای دیگر توسط shuang و همکارانش در چین روی 174 مورد سه قلو ها GRIK2 در روی ناحیه 6q21 قرار داشته و به عنوان منطقه مستعد کننده به اوتیسم شناخته شده است .
GAD1 پروتئین 67 کیلو دالتونی گلوتامیک اسید دکربوکسیلاز (GAD67) که آنزیمی مهم در تبدیل گلوتامات به گابا GABA است را کد گذاری میکند . به عنوان یک دکربوکسیلاز این آنزیم نیاز به ویتامین ب6 به عنوان کوفاکتور دارد که بعضی ها تصور می کنند در درمان اوتیسم نقش دارد. این کدگذاری در کروموزوم 2q رخ می دهد که ارتباطی با چندین طیف وسیع ژنها دارد . مطالعاتی هم روی ژنها بعد از مرگ مبتلایان به اوتیسم انجام شده است از مجموع مطالعات اینچنین بر می آید که ژنها و پروتئین های در گیر در عملکرد گلوتامات و GABA ممکن است در مبتلایان به اوتیسم غیر نرمال باشند اما نتایج قطعی ابراز نشده است.
نوروپپتیدها
اکسی توسین و وازوپرسین
پپتیدهای 9 اسید آمینه ای اکسی توسین (OT) و وازوپرسین (AVP) در بروز رفتارهای اجتماعی در پستانداران نقش دارند. این نوروپپتیدها در هیپوتالاموس ساخته می شوند و از قسمت پشتی هیپوفیز ترشح می شوند و تنها در پستانداران وجود دارندو فقط در 2 اسید آمینه با هم متفاوتند. رسپتورهای این پپتیدها در سراسر دستگاه لیمبیک و قسمت قدامی مغز و در ساقه مغز در مراکز اوتونومیک یافت می شوند . نقش تنظیم کننده این نوروپپتید ها در تنظیم رفتارهای پستانداران زمینه بررسی در مورد یافتن پاتوفیزیولوژی بیمارن PDD را گشوده است. حذف OT در موشها سبب نقص فعالیتهای اجتماعی با دست نخوردگی در شناخت عمومی و سیستم بویایی می شود .OT سبب تقویت روابط جفتی و انفوزیون آنتاگونیست اکسی توسین در هسته های تکیه ایaccumbense سبب مهار شکل گیری فرایند جفت یابی در موشهای صحرایی دشتها می شوند . در موشها وازوپرسین سبب تسهیل حافظه اجتماعی و در موشهای صحرایی نر این نوروپپتید سبب تقویت حس جفت یابی می شود.
این نظریه که در معرض قرار گرفتن نوزادان به اکسی توسین در جریان القا زایمان سبب تنظیم معکوس(Down regulation) رسپتورهای این ماده می شود در دو مطالعه جداگانه بر روی کودکان PDD و با اختلالات گفتاری اوتیسم اثبات نگردید. اما در دو مطالعه جداگانه با اندازه گیری سطح خون محیطی اکسی توسین مشخص گردید که سطح این ماده کاهش یافته است اما در مطالعه دوم سطح خونی پیش ساز اکسی توسین که در سه اسید امینه آخر در مولکول متفاوت است افزایش یافته است و این مطلب با توجه به تاثیر اکسی توسین در بروز رفتارهای اجتماعی در پستانداران سبب این نظریه شده است که ممکن است نقص یک تبدیل کننده در مسیر سنتز اکسی توسین سبب کاهش غلظت این ماده در خون محیطی می گردد . اما در یک مطالعه که در آن به 9 بالغ مبتلا به اوتیسم و 6 بالغ مبتلا به آسپرگر مورد آزمایش با انفوزیون اکسی توسین قرار گرفتند و از لحاظ رفتارهای تکراری و یا اجتماعی بررسی شدند ولی هیچ تغییر بارزی ایجاد نشد که بدین ترتیب تاثیر اکسی توسین در رفتارهای اجتماعی را زیر سوال میبرد.
بررسی های رفتارهای اجتماعی نامطلوب در افراد PDD هنوز با شواهد اپیدمیولوژیک ، نوروشیمیایی و درمانی و ژنتیکی جمع آوری شده از اثرات اکسی توسین و وازوپرسین قابل استناد نیستند. مطالعات آینده می بایست روی سطح خونی این ماده در مغز تمرکز کنند و بر علت یابی تاثیر متفاوت این مواد بر جنس پستانداران سطح پایین تر تمرکز کنند.
اپیوئیدها
چندین مطالعه روی کودکان اوتیستیک بر بد تنظیمی اپیوئیدها به عنوان اتیولوژی بیماری در افراد PDD انجام شده است. علائم ناشی از این بد تنظیمی را شامل افزایش آستانه درد، علاقه کم به تعاملات اجتماعی و اپیزودهای بیش فعالی می دانند. این یافته ها در کودکان حیواناتی که اپیوئید دریافت کرده اند دیده می شود. سیستم اپیوئیدی انسان با محور هیپوتالاموسی _هیپوفیزی _آدرنال و دیگر نوروپپتید ها مرتبط است. زیرا بتا اندورفین درست در همان زمان ترشح کورتیکوتروپین (ACTH) از هیپوفیز قدامی ترشح می شود. این حالت به این علت اتفاق می افتد که این هورمون های پپتیدی بطور اولیه قسمتی از همان پیش هورمون هستند.
ارزیابی این پپتیدها در خون و مایع مغزی نخاعی و ادرار بیماران PDD نتایج متفاوتی داشته است. بعضی نتایج افزایش و بعضی کاهش و بعضی نسبت به گروه کنترل بدون تغییر بودند.
در مطالعاتی که بر روی اثر naltrexon که یک آنتاگونیست اپیوئیدهاست بر روی کودکان PDD انجام شده است نتایج متضادی داشته است و اندازه گیریهای بتا اندورفین ها نیز نتایج همگونی نداشته است.
نتیجه اینکه سیستم اپیوئید اندوژن و اگزوژن در بیماران PDD نیاز به مطالعه بیشتری دارد و این نظریه را ایجاد کرده است که سطح خونی بتا اندورفین ممکن است به تنهایی سبب بیماری نشود اما اثر متقابل اپیوئیدها با دیگر نوروترانسمیترها نظیر 5HT ،DA نوراپی نفرین و گلوتامات و یا سیستم گابا باعث بروز علائم رفتاری افراد PDD میشود. رفتار نهایی اپیوئیدها در پاتوفیزیولوژی PDDها ممکن است از مهار فعالیت اکسی توسین ناشی شود چنانچه در موشها دیده شده است. در نهایت مطالعه بسیاری برای درک تعامل سیستم اپیوئیدها با نوروترانسمیترهای معمولی وبا دیگر نوروترانسمیترها نیاز است.
کورتیزول/ACTH سطوح هورمونهای قسمت قدامی غده هیپوفیز و ACTH و محصولات غده آدرنال در بیماران PDD برای ارزیابی محور HPA بررسی شده است اما نتایج مانند گذشته متناقض بوده است. در یک مطالعه بر روی 36 کودک اوتیستیک سطح بالای ACTH همراه با سطح پایین کورتیزول گزارش شده است که به این تضادها بیشتر دامن می زند و در مطالعه ای دیگر بر روی سطح سیرکادین هورمون کورتیزول تفاوتی با گروه کنترل نداشته اند.
ملاتونین
این نظریه قبلا" داده شده است که ترشح بیش از حد ملاتونین از غده پینه آل ممکن است مسئول تاثیر روی محورHPA باشد که بنابراین ممکن است به یک فنوتیپ رفتاری شبه اوتیستیک فرد را هدایت کند. این تئوری از آنجا بروز کرد که دیده شد در حیوانات ملاتونین افزایش یافته سبب کاهش ترشح هورمون آزاد کننده کورتیکوتروپینCRP می شود این خود سبب کاهش ترشح ACTH و بتا اندورفین شده در حالیکه با یک مکانیسم ناشناخته سبب افزایش 5HT در کل مغز می شود. در یک مطالعه روی 16 کودک PDD برای ارزیابی سطح 24 ساعته ملاتونین گزارش شد که سطح متوسط آن نسبت به افراد نرمال تغییری نداشته است اما تمایل به کاهش در پیک شبانه در بیماران اوتیستیک دارد. نقش دقیق ملاتونین همچنان نامعلوم مانده و شواهدی وجود دارد که به نقص اولیه ملاتونین اشاره می کنند.
سکرتین
گرچه نقش سکرتین در سیستم گوارشی شناخته شده است اما نقش آن به عنوان نوروپپتید هنوز در پرده ابهام است . گرچه گزارشات ابتدایی از اثر بخشی این هورمون در درمان بیماران اوتیستیک حکایت داشتند اما مطالعات کنترل شده این اثر بخشی را تایید نکردند.
شواهد اخیری از خواص نورواکتیو سکرتین مشخص گردیده است. در نمونه های انسانی و موشی و نمونه های موشی به تنهایی واکنش ایمنی سلولهای پورکنژ مخچه و هسته مرکزی مخچه و سلولهای پیرامیدال کورتکس حرکتی و نورونهای حسی اولیه و ساقه مغز نشان داده شده است.
یک مطالعه دیگر بر روی موشها کدگذاری mRNA برای رسپتورهای سکرتین در بین نورونهای مخچه ای GABA انجام شده است.
با این مطالعه پذیرفته شده است که سکرتین ممکن است توسط سلولهای پورکنژ مخچه ترشح شود و سپس به صورت پیامبر برگشتی تعدیل کننده فعالیت GABA عمل می کند. واضح است که احتمالا" سکرتین اثر نورواکتیو دارد ولی اثر بالقوه این هورمون در پاتوفیزیولوژی PDD بسیار کم شناخته شده است و نقش آن در درمان اثبات نگردیده است.
هورمون تیروئید
هورمون محرک تیروئید که توسط غده هیپوفیز ترشح می شود در چندین مبتلا به اوتیسم اندازه گیری شده است اما در مقایسه با افراد نرمال تغییر نداشتند.
دیگر هورمونهای غده هیپوفیز
هورمون رشد ، پرولاکتین ، LH و FSH در کودکان اوتیستیک تفاوتی با افراد نرمال نداشته است
دیگر نوروپپتیدها و نوروتروپینها
یک آنالیز جدید نوروپپتیدها و نوروتروپینها از نمونه های فریز شده خون نوزادان تشخیص داده شده به عنوان PDD (N=63) در مقایسه با عقب ماندگان ذهنی بدون اوتیسم ( 54 نفر ) و فلج مغزی ها (63 نفر ) و افراد نرمال (54 نفر) و تعدادی از نوروپپتیدها در کودکان عقب مانده ذهنی و PDD بالاتر از نرمال بودند غلظت پپتید وازواکتیو روده ای(VIP) و پپتید مرتبط با ژن کلسیتونین (CGRP) و فاکتور نوروتروپیک مشتق شده از مغز (BDNF) و نوروتروفین 5/4 بطور بارزی در کودکان PDD و عقب مانده بالاتر از نرمال بودند اما تغییری بین افراد PDD و عقب مانده ذهنی غلظت ماده P ، پلی پپتید فعال کننده آدنیلات سیکلاز (PACAP)
فاکتور رشد عصب(NGF) و نوروتروفین 3 دیده نشده است و در تمام گروه ها مشابه بودند. در یک مطالعه دیگر سطح مایع مغزی نخاعی فاکتور نوروتروفیک و فاکتور1 رشد شبیه به انسولین در 11 کودک اوتیستیک و 11 بیمار کنترل ناتوان هم سن مشابه بودند.
هنگامیکه نمونه های نوزادان ممکن است برای PDD اختصاصی نباشد اما این نکته را اشاره می کنند که بد تنظیمی نوروپپتید-نوروتروفین ها مغز را به سمت بروز PDD هدایت می کند.
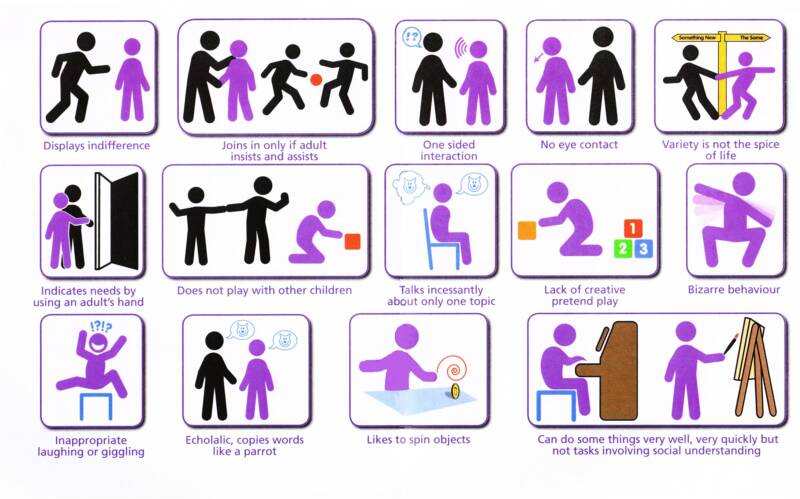
مشخصات ویژه ی اتیسم چیست؟
درجه ی شدت و حدت نشانه های این بیماری از فردی به فرد دیگر متفاوت است اما به طور معمول شامل موارد ذیل میگردد :
یک: تکلم این افراد بسیار کند پیشرفت میکند،اگر اصلا پیشرفتی داشته باشد. در صورت پیشرفت در زبان آموزی، معمولا نتیجه شامل الگوهای گفتاری ویژه یا استفاده از لغات در معنی های غیر از معانی اصلی آنها خواهد بود. آن دسته از آنان که می توانند بطور موثر از زبان استفاده کنند، کماکان از استعارات و معانی غیر معمول استفاده کرده و به شیوه ای صوری و با آهنگ صدای یکنواخت صحبت خواهند کرد.
دو: این افراد روابط اجتماعی را با درنگ و تاخیر قابل ملاحظه ای درک می کنند.
سه:کودک مبتلا به اتیزم(اتیستیک) معمولا از تماس چشمی خودداری میکند،در مقابل در آغوش گرفته شدن مقاومت میکند و با دنیای اطراف خود ناهماهنگ به نظر می رسد.از جمله عوامل ایجاد این ضایعات،فقدان بازی های گروهی با هم سالان،مشکل شدید در برقراری ارتباط ،و عدم توانایی آنان در درک احساسات دیگر افراد است.
چهار:وجود الگوهای متناقض در واکنش های حسی
کودک اتیستیک ،ممکن است گاهی ناشنوا به نظر آید و چنین بنماید که توانایی واکنش به کلمات و دیگر اصوات را ندارد؛اما همان کودک در زمانی دیگر ممکن است از برخی صداهای عادی روزمره، مانند صدای جاروبرقی و پارس سگ به شدت پریشان و مضظرب شود.
چنین کودکی ممکن است آشکارا نسبت به هرگونه درد بی اعتنا باشدیا نسبت به سرما و گرما هیچ گونه پاسخدهی حسی نداشته باشد،اما در زمان دیگر نسبت به همین عوامل عکس العملی بسیار شدید نشان دهد.
پنج:الگوهای غیر عادی کارکرد ذهنی
فرد اتیستیک ممکن است توانایی های پیشرفته ای (به معنی استفاده از اشیا به صورت مناسب در رابطه با کارکرد آنها)در مسایلی چون نقاشی،موسیقی،محاسبات ریاضی یا به یاد سپاری مسایل بدون توجه به اهمیت یا بود و نبود آن داشته باشد.
از طرف دیگر،غالب افراد اتیستیک درجات مختلفی در عقب ماندگی ذهنی دارند،و تنها 20 درصد آنها دارای هوش معمولی یا بیش از معمولی هستند.این آمیزش درجات مختلف هوشی در اتیزم،آن را بسیار پیچیده می سازد.
شش:محدودیت آشکار در فعالیت ها و علایق
فرد اتیستیک ممکن است مکرر و تکراری بدنی داشته باشد،حرکاتی مانند تکان ممتد دست،تکان های مار پیچی،چرخیدن و جنبیدن بصورت تکرار یک حرکت. فرد ممکن است این تکرار را در طی کردن چند باره ی یک مسیر،پوشیدن لباس تنها به یک صورت یا انجام برنامه ی روزانه ی ثابت(تکراری) یا چیز های دیگر نیز نشان دهد.شایان ذکر است که اگر تغییری در این روال عادی و تکراری رخ دهد،کودک غالبا دچار اضطراب و پریشانی .
درمانهای رژیمی و داروئی
از آنجائی که اُتیسم یک طیف از بیماریهای مشابه است نمی توان گفت که یک درمان خاص برای همه این طیف می تواند مؤثر باشد . ولی به هر حال متخصصین و خانواده ها به این نتیجه رسیده اند که با استفاده از چند روش درمانی و یا ترکیبی از آنها می توان به کودکان اُتیستیک کمک کرد تا رفتارهای اختلالی آنها بهتر شده و عملکرد کلّی آنها پیشرفت کند . این ترکیب درمانی می تواند ترکیبی از روشهای روانشناسی و داروئی باشد . تاکنون داروئی یافت نشده است که از بروز اُتیسم جلوگیری کند و یا اینکه آنرا درمان کند ولی متخصصین و خانواده ها به تجربه دریافته اند که بعضی از داروهای استفاده شده در بیماری های دیگر ، در بهبود بعضی از اختلالات اُتیسم مؤثر می باشند . همچنین مشاهده شده است که تغییرات رژیم غذائی و افزودن برخی ویتامین ها و موادمعدنی می تواند در بهبود برخی از اختلالات اُتیسم مؤثر باشد .در طی ده سال گذشته تحقیقات زیادی در این مورد انجام شده که نتایج برخی از آنها حاکی از این است که افزودن برخی ویتامین ها مانند ب6 و ب12 و همچنین حذف برخی مواد مانند گلوتن و کازئین از رژیم غذائی کودک می تواند در بهبود عملکرد سیستم گوارشی ، آلرژی ها و رفتارهای کودک تأثیر مثبت داشته باشد . البته تمامی تحقیقات و بررسی ها این مطلب را به صورت علمی و قطعی ثابت نمی کنند .
تعدادی از داروهای بیماریهای دیگر وجود دارند که در مورد بعضی از کودکان اُتیستیک اثرات مثبت نشان داده اند.این داروها معمولاً در درمان بیش فعّالی ، اختلالات توجه ، و نگرانی در کودکان اُتیستیک مؤثر بوده اند . در اصل می توان گفت هدف از استفاده دارو در کودکان اُتیستیک ، کاهش رفتارهای اختلالی در جهت استفاده بهتر و بیشتر کودک از جلسات درمانی می باشد . سعی کنید در صورتی که متخصصین برای کودک شما دارو تجویز می کنند این سئوالات را از آنها بپرسید : آیا این دارو اثرات جانبی در کودک خواهند داشت ؟ چه مقدار در طی روز باید استفاده شود ؟ به چه نحو باید استعمال شود ؟ در دراز مدت چه تأثیراتی خواهد داشت ؟ چه کسی و چگونه تأثیرات این دارو را در کودک بررسی خواهد کرد ؟آیا آزمایشات بخصوصی را قبل از استفاده این دارو باید انجام داد ؟ آیا استفاده این دارو هم زمان با سایر داروها و ویتامین ها مشکلی نخواهد داشت ؟
به هر حال به خاطر داشته باشید که استفاده از هر داروئی برای کودکان اُتیستیک باید حتماً زیر نظر متخصص انجام شده و اثرات آن به دقت تحت بررسی باشد .
شاید بتوان گفت یکی از بیشترین ویتامین های استفاده شده برای کودکان اُتیستیک ، ویتامین ب می باشد .این ویتامین در ساختن آنزیمهائی که مغز برای فعّالیت خود به آنها احتیاج دارد مؤثر است .در 18 تحقیقی که در مورد این ویتامین انجام شده است نشان داده شده است که حدود نیمی از کودکانی که این ویتامین در رژیم غذائی آنها بیشتر شده بود ، تأثیرات مثبتی در آنها به وجود آمده بود که این تأثیرات شامل بهبود رفتار ، بهبود تماس چشمی ، توجه بیشتر ، و افزایش توانائی یادگیری در این کودکان بود. در بعضی از کودکان ، روغن جگر ماهی که حاوی مقادیر فراوانی ویتامبن های آ و د می باشد تأثیرات خوبی در افزایش تماس چشمی و بهبود رفتاری داشته است . ویتامین ث نیز در عملکرد بهتر مغز تأثیر دارد و استفاده آن در برخی از کودکان اثرات مثبت داشته است . در صورتی که قصد استفاده از ویتامین ها را برای کودک خود داشتید می بایست حتماً با دکتر متخصص کودک خود مشورت نمائید و در صورت لزوم آزمایشاتی را انجام دهید تا مطمئن شوید استفاده بیش از حد معمول این ویتامین ها اثرات جانبی و مخرب بر روی کودک شما نخواهد داشت . برخی از کودکان اُتیستیک در مورد بعضی از موادغذائی حساسیت هائی از خود نشان می دهند و حتی ممکن است در مورد آن آلرژی نیز پیدا کنند . ممکن است این حساسیت ها و آلرژی به صورت رفتارهای اختلالی در کودک بروز کنند .گزارشهای فراوانی از والدین و متخصصین وجود دارند که حاکی از آن است که حذف این مواد غذائی از رژیم غذائی کودک باعث پیشرفت چشمگیر و بهبود رفتاری شده است . در برخی از کودکان اُتیستیک مشاهده شده است که پروتئین هائی نظیر گلوتن و کازئین به خوبی شکسته نمی شوند و باعث بروز مشکلاتی در کودک می شوند .حذف این پروتئینها در این کودکان می تواند به رفع اختلالت گوارشی در آنها کمک کند و در نتیجه رفتارهای اختلالی ناشی از آن نیز رفع می گردند . گلوتن در غلات و کازئین در لبنیات وجود دارند . باید توجه داشت که در صورت وجود این مشکل در کودک شما ، نباید غلات و لبنیات به یکباره از رژیم غذائی کودک حذف شوند زیرا ممکن است این قطع ناگهانی خود باعث بروز مشکلات دیگری شود . برای این منظور بهتر است با یک متخصص تغذیه مشورت شود تا نحوه حذف این مواد و تغییر مناسب رژیم غذائی به شما آموزش داده شود
دانشمندان آمریکایی با استفاده از یک رویکرد آماری مناطقی از دی.ان.آ را کشف کردهاند که به نظر میرسد با ابتلا به اختلالات طیف اوتیسم ارتباط دارد.
به گزارش پایگاه اینترنتی ساینس دیلی، محققان در "دانشکده پزشکی دانشگاه واشنگتن" در سنت لوییس و "دانشگاه کالیفرنیا- لوس آنجلس" دو منطقه از دی.ان.آ را که با اوتیسم ارتباط داشت، کشف کردند.
نسبت به گروههای پرشماری که معمولا در تحقیقات برای ژنهای اوتیسم مورد مطالعه قرار میگیرند، این بار محققان این دی.ان.آ مشکوک را در گروه بسیار کوچکتری از افراد مورد مطالعه پیدا کردند.
دکتر "جان کنستانتینو" از دانشگاه واشنگتن که در این مطالعه شرکت داشت گفت، در تحقیق قبلی چند منطقه از دی.ان.ای که با اوتیسم ارتباط داشت، جدا شد اما تعداد بسیار اندکی از این مطالعات تکرار شدهاند بنابراین تاکنون هیچ ژن اوتیسم مشخصی تشخیص داده نشده است.
کنستانتینو گفت، در مطالعات قدیمیتر از چیزی که طرح "خواهران و برادران مبتلا" خوانده میشود، استفاده شده است.
این طرح در خواهر و برادران مبتلا به اوتیسم به دنبال نشانگرهای ژنتیک میگردد.
وی افزود، این رویکرد در اختلالات تک ژنی موثر بود اما اوتیسم بیماری پیچیدهایست که احتمالا ژنهای بسیاری در آن نقش دارند و نقش هر یک از آنها بسیار اندک است. به این ترتیب، زمانیکه ژنهای بسیاری در کار باشند یافتن نشانگرهای ژنتیک دشوارتر است.
این مطالعه در شماره آوریل مجله آمریکایی "روانپزشکی " منتشر شده است.
به گفته پزشکان وجود تلفنهای همراه و سایر دستگاههای متکی به فناوری بی سیم به دلیل ایجاد تراکم میدانهای مغناطیسی در فضا، شیوه بیماری اوتیسم را در میان کودکان افزایش داده است.
به گزارش سلامت نیوزبه نقل از پایگاه خبری رویترز؛ پژوهشگران معتقدند افزایش روز افزون استفاده از دستگاههای فناوری بی سیم نظیر تلفنهای همراه، تراکم میدانهای مغناطیسی را در بدن بیماران افزایش میدهد که به دنبال آن تاثیر میدان مغناطیسی بر مغز افراد افزایش استرس و تنشهای روحی است.
بنابراین گزارش و به گفته پزشکان جریانهای الکتریکی و میدانهای مغناطیسی بر روی مغز آثار منفی دارد که بروز اوتیسم یکی از عوارض ناشناخته آن است.
یادآور میشود؛ هم اکنون از هر 15 کودک در آمریکا یک نفر به اوتیسم مبتلا است به طوری که این رقم تا قبل از ورود تلفنهای همراه و رایانهها به زندگی افراد، سال 1970 نسبت 1 به 100 داشت.
برای آنکه بهترین سرویس را به یک کودک مبتلا به اوتیسم ارایه دهیم باید به موارد ذیل توجه نماییم:
۱ـ کودک ما حتما" باید توسط یک متخصص روانپزشکی اطفال و یک متخصص مغز و اعصاب اطفال ویزیت شود.
۲ـ به طور فشرده و ترجیحا" هر روز تحت خدمات گفتار درمانی قرار گیرد.
۳ـ لازم است والدین و مربی کودک روشهای مناسب تقویت مهارتهای ارتباطی کودک را از طریق مطالعه کتابهای مرتبط و یا بوسیله جلسات مشاوره ای که گفتاردرمانگر کودک برگزار میکند فرا بگیرند.
۴ـارزیابی وضعیت حسی ـ حرکتی کودک بوسیله کارشناسان کاردرمانی صورت پذیرد و در صورت لزوم جلسات کاردرمانی ذهنی کودک به طور منسجم برگزار گردد.
منبع: ایران اتیسم
دارد به سرعت رشد می کند!!!
آمارهای تکان دهنده ای از سراسر دنیا درحال جمع آوری و اخطار هستند. اوتیسم دارد به سرعت رشد می کند. گرچه هنوز از چیستی و چرایی اوتیسم آنچنان که باید به صورت متقن و علمی فراهم نشده است اما تلاش های بسیاری صورت گرفته تا در رفع این نقیصه ی ذهنی و روانی و ژنتیکی گامهای برداشته شود که گاها این تلاش ها مثمر ثمر واقع شده و اکثر این روشها بسیار طاقت فرسا و زمانگیر بوده است. خصوصا تکنیک های تدریس و برقراری ارتباط با این کودکان.
چرا اوتیسم به سرعت دارد رشد می کند؟ هنوز پاسخ درخوری یافت نشده است اما جالب است بدانید که بسیاری از رفتارهایی که تکنولوژی جدید باعث آن است شباهت های زیادی با در خودماندگی دارد.